转自BioAr,zZ原创
Nature综述文章:Bridging structural and cell biology with cryo-electron microscopy
多年来,细胞生物学家们一直在尝试不同的技术来对细胞进行成像,并期望从时间和空间尺度上理解细胞行为。然而,这些成像技术的分辨率很少能够达到足以让人们理解其中化学反应的程度。冷冻电子显微镜的出现极大地促进了人们对细胞内大分子功能型复合物的理解,它所能达到的超高分辨率可以为解释细胞运作提供更加细节的化学视角。
近日,来自加州大学伯克利的Eva Nogales和来自欧洲分子生物实验室的Julia Mahamid在Nature上发表了题为Bridging structural and cell biology with cryo-electron microscopy的综述。该文章主要探讨了冷冻电子显微镜(cryo-EM, cryo-electron microscopy) 和冷冻电子断层扫描 (cryo-ET, cryo-electron tomography) 之间的异同,以及冷冻电镜的整体发展和其在细胞生物学中的应用。
作者首先对cryo-EM和cryo-ET的异同进行了简要介绍。Cryo-EM的技术最早可以追溯到上世纪五六十年代,随着几十年来的不断改进和发展,cryo-EM成为了解析生物大分子的强大工具。相比于X射线晶体衍射和核磁共振波谱,cryo-EM通常需要更少的样品材料,并且对于分子的大小要求也没有上限。与cryo-EM分离纯化样品分子不同,cryo-ET通常在复杂的细胞环境内对分子进行原位成像;cryo-EM一般获得单张分子图像,而cryo-ET一般获得不同角度的图像序列,这些图像序列可以通过分析获得三维的分子结构。因此,cryo-EM的研究对象一般在组成和构象变化方面相对简单,而cryo-ET的研究对象相对来说会有更高阶的组装模式。
接下来,作者提到,近年来冷冻电镜的技术发展主要体现在探测器的发展、样品处理和新型软件平台的开发:(1) 直接电子探测器 (DED, direct electron detector) 的发展极大地提高了图像的对比度和分辨率,(2) 聚焦离子束切割 (FIB, focused ion beam) 的应用与传统冷冻切片相比,大大减少了对样品的干扰,(3) 新型软件平台的创新进一步促进了cryo-EM的精确数据分析。
随着冷冻电镜技术的发展,目前冷冻电镜可以处理的样品也逐渐复杂化。相比于传统的X射线晶体衍射常用的过表达蛋白后再纯化相比,由于冷冻电镜需要的样品量较少,人们可以直接利用CRISPR技术将内源蛋白连上标签后直接纯化内源蛋白,这样可以保证最后分析的蛋白最接近体内的真实状态。而对于复杂的蛋白复合物,则需要利用cryo-ET并且结合一系列计算程序来尽可能确保结构的可信度。另一方面,人们也在放宽对蛋白提取的纯度要求,而转向对细胞裂解物等粗提样品进行粗略的结构分析,这种方法可以有助于复杂混合物的初始模型构建。除了对样品进行体外分析之外,直接研究细胞样品可以提供更偏向真实生理的信息。冷冻电镜已经在细胞切片 (FIB) 中有显著的进展,如果研究者想观察整个细胞或组织的话,将FIB切割和扫描电子显微镜 (FIB-SEM) 结合起来,再通过图像处理可以获得保真的超分辨电镜细胞图像。
当研究者获得复杂的细胞图像后,他们需要对细胞内的分子进行辨别和区分。通常有两种方法可以被用来定性这些分子:(1) 光电联合显微镜 (CLEM, correlated light and electron microscopy),通过对目标分子连上荧光分子来区分目标分子和其他结构;(2) 利用分子标签来直接指示目标分子的位置,可以是电子颗粒密度的差别也可以是目标分子的特殊结构。当然,为了获得更保真的超微结构,以上这些都离不开更细致的数据分析手段。
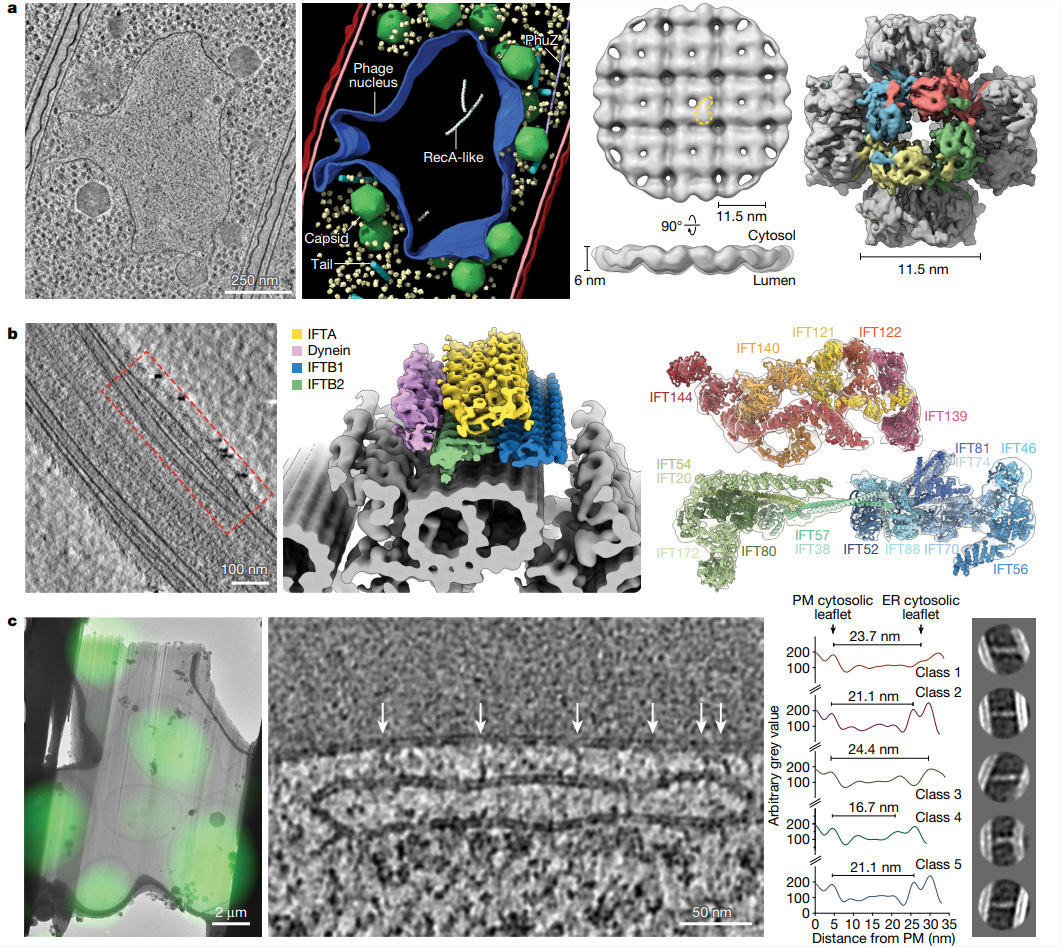
Fig 1. 用cryo-ET可视化细胞结构。
最后,作者介绍了cryo-EM和cryo-ET的结合应用。由于cryo-ET的结构分辨率通常低于cryo-EM, 而cryo-ET可以对接近生理状态下的细胞或组织成像,这两种方法的互相补充可以用于解释和补充低分辨率的cryo-ET图像。例如,当cryo-ET获得的细胞图像尚未达到足以让系统预测其中复合物的程度时,cryo-EM获得的高分辨率结构模版可以帮助cryo-ET在原位细胞中辨别目标复合物。辨别的方法有两种:(1) 在cryo-ET获得的3D结构中直接进行模版匹配,但由于cryo-ET的分辨率限制,人们也可以 (2) 众多切片中的单个高分辨率图像中进行2D模版匹配。但在更多情况下,这两种方法会同时进行,相辅相成以确保预测的准确度。另外,cryo-ET也可以与细胞的荧光成像甚至是单细胞组学数据结合,为细胞调控提供全新的机制性理解。
提到近来的结构生物学发展,便不可不提蛋白结构预测领域中人工智能 (如AlphaFold或RosettaFold) 的广泛应用。尽管可能有人担心实验性结构生物学可能将被人工智能代替,但作者表示人工智能预测蛋白结构可以是实验性结构生物学的强大助力。将人工智能的预测与cryo-EM或cryo-ET获得的电子密度图结合,这样的实验流程将会显著加速结构模型的建立,并使得解释捕获的真实细胞内的分子结构的过程更加便捷。
总而言之,细胞生物学和结构生物学的互补是人们理解细胞世界不可或缺的途径,而冷冻电镜的发展将会使人们对真实细胞活动的理解上升到另一个超微尺度。
原文链接:https://www.nature.com/articles/s41586-024-07198-2
| 电话 010-52571502 010-51248120 邮箱 hedebio@163.com |